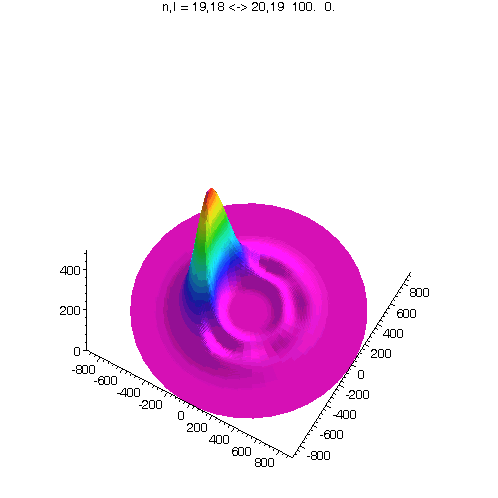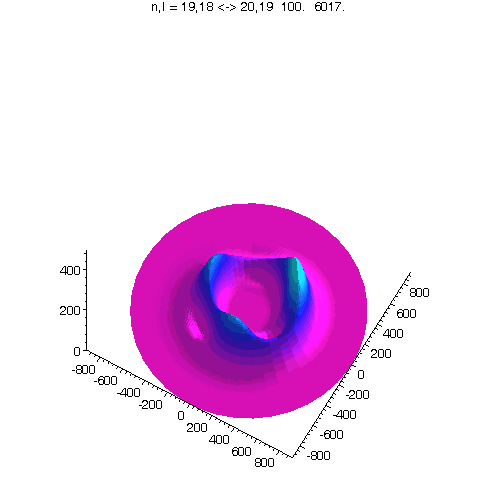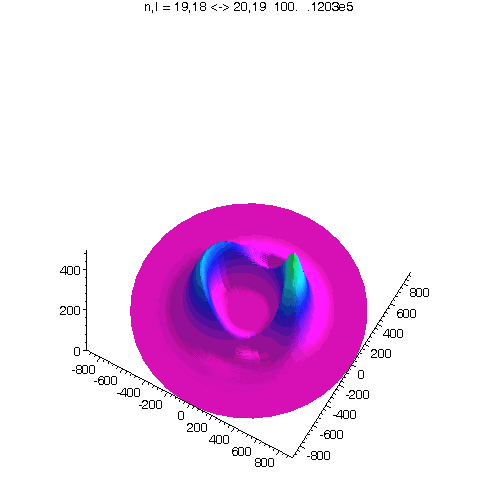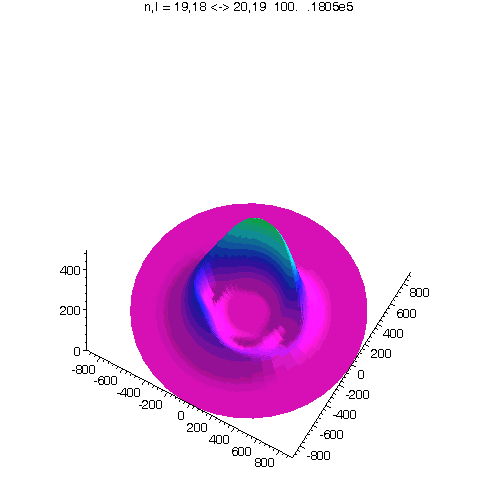
l = m = n-1, 40 Bilder
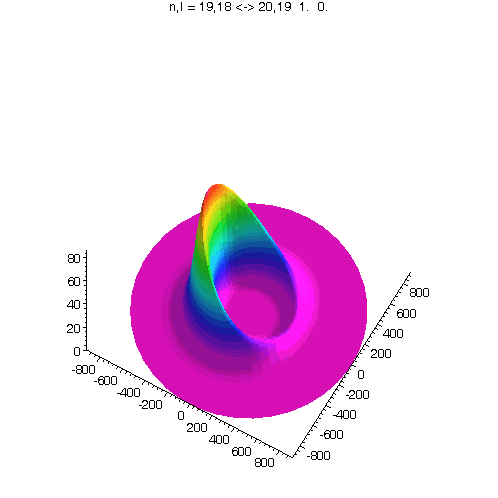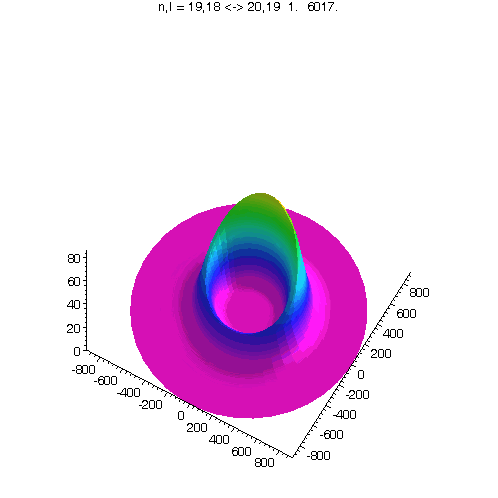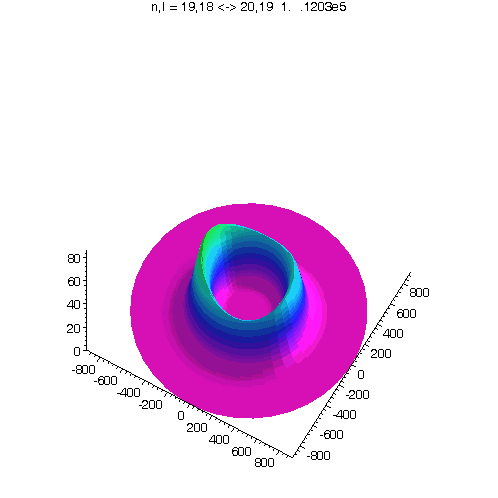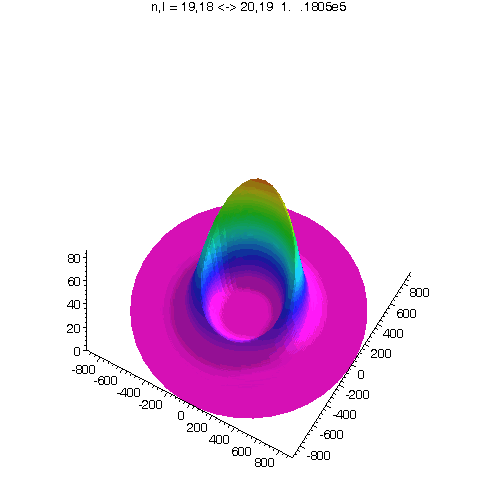
"Kreisförmiges Rydbergatom": Bahndrehimpuls- und magnetische Quantenzahl haben in jedem der fünf Zustände ihren maximalen Wert (der Drehimpulsvektor zeigt nach oben). Das Maximum der Aufenthaltswahrscheinlichkeit rotiert in der "Äquatorebene des Atoms" auf der 19. Bohrschen Bahn (mit einer leichten Unwucht ;-)). Allerdings zerfließt das Maximum und lebt an mehreren Stellen wieder auf (fractional revival). Siehe auch: Kreisförmige Rydbergatome
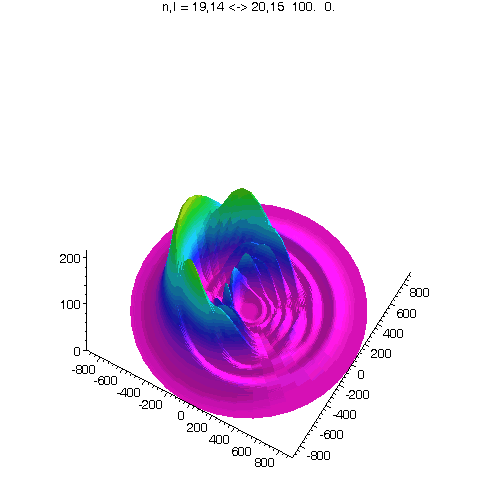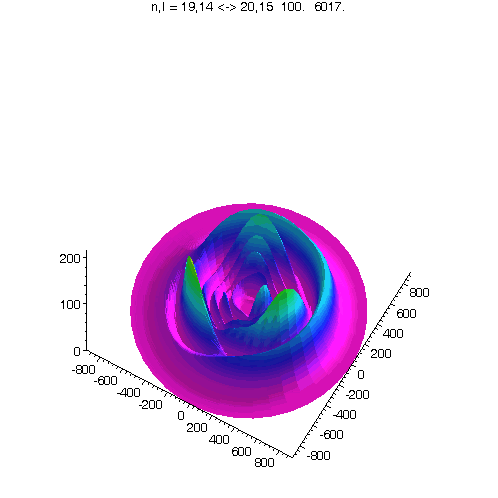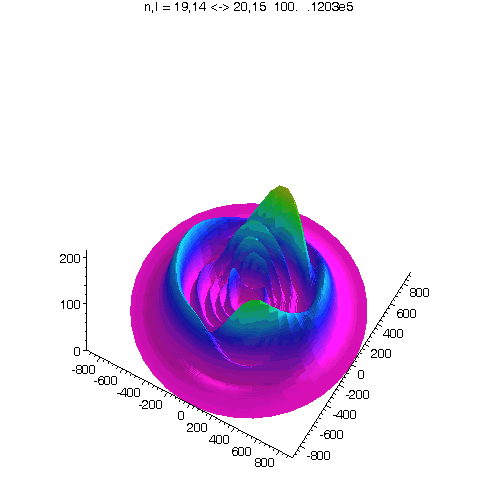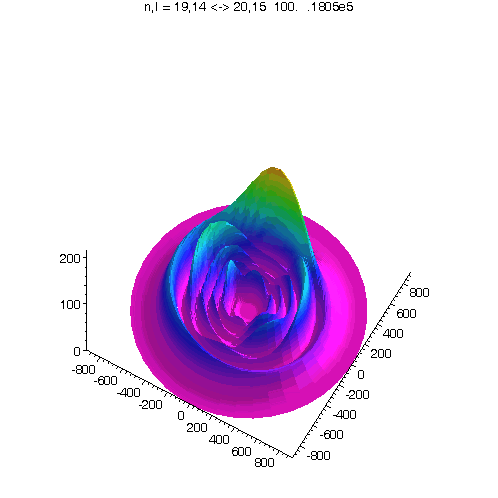
l = m = n-5
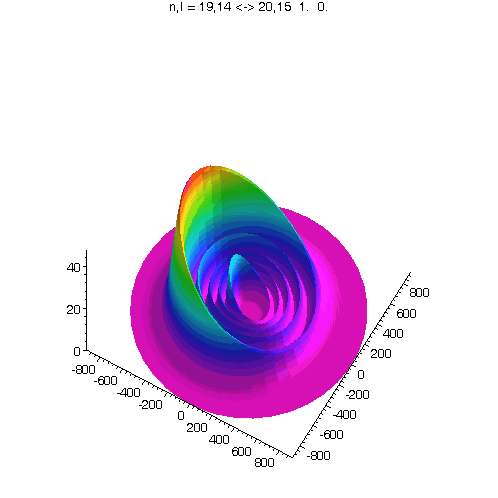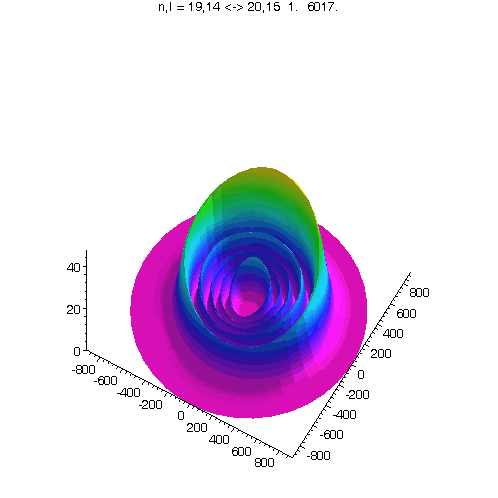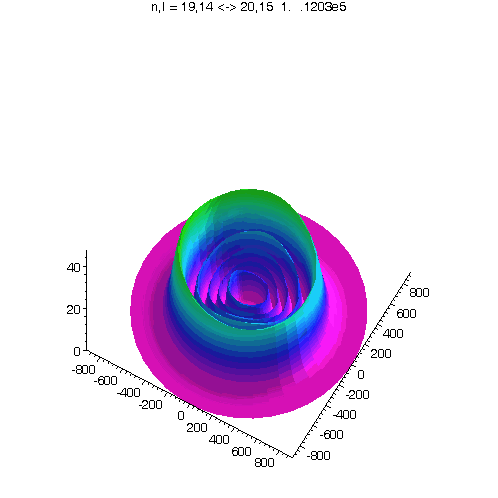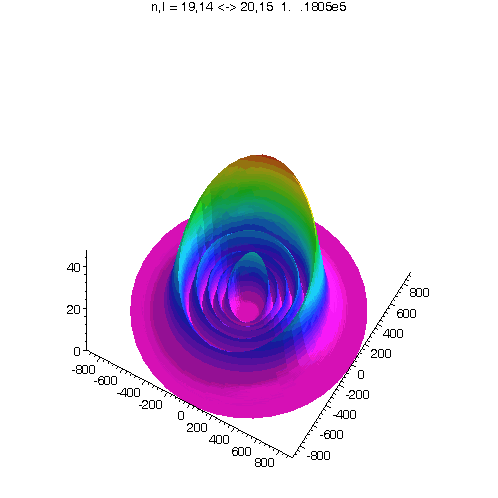
Bei kleinerem Drehimpuls werden Perihel und Aphel sichtbar.
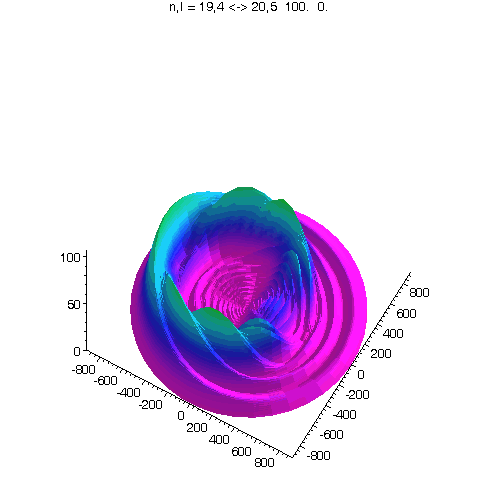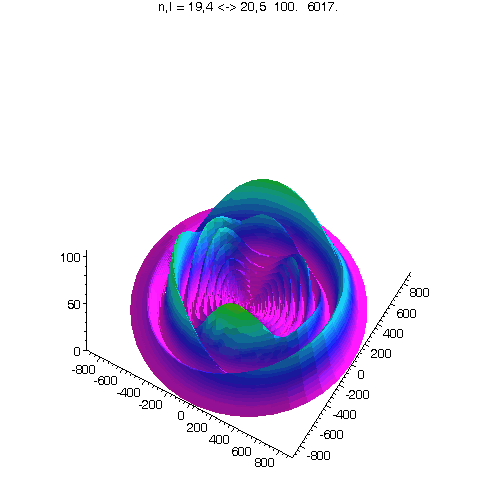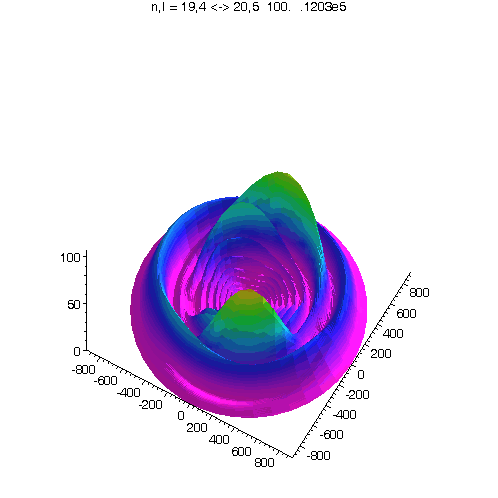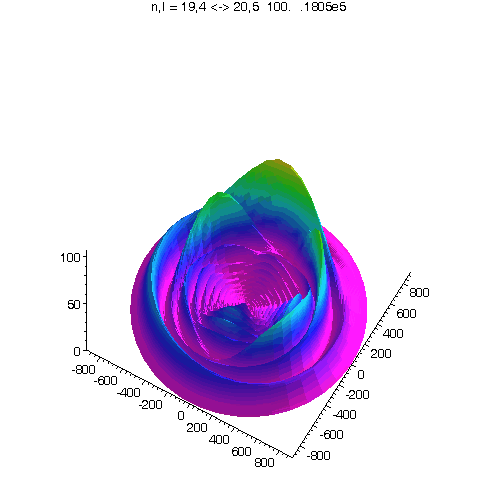
l = m = n-15

Bei noch kleinerem Drehimpuls werden die Ellipsenbahnen immer exzentrischer...

l = 1, m = 0, 80 Bilder
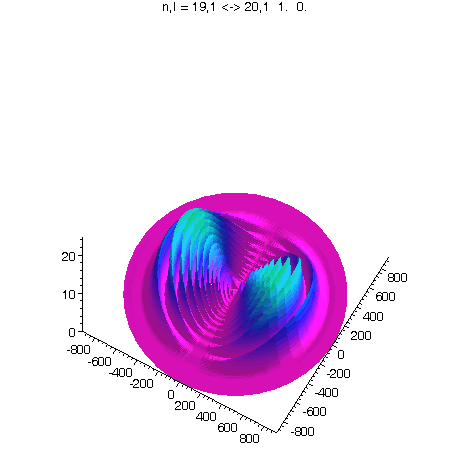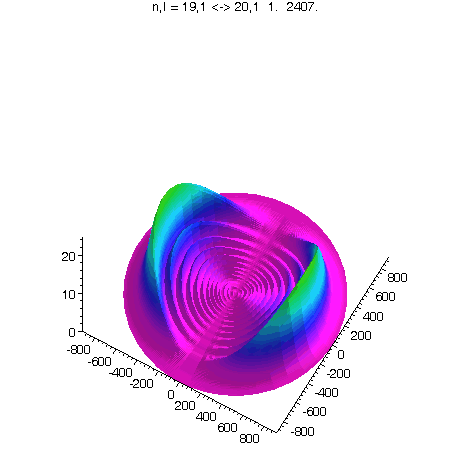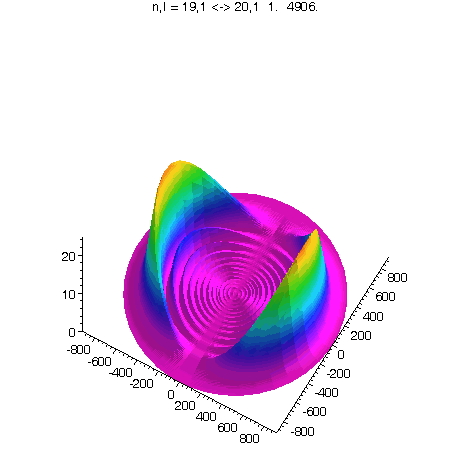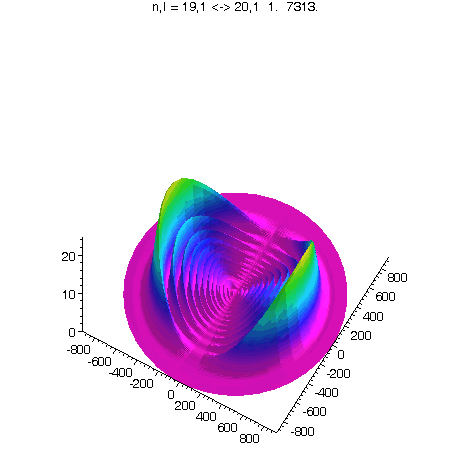
J.A.Yeazell and C.R.Stroud, Jr., Observation of fractional revivals in the evolution of a Rydberg atomic wave packet, Phys. Rev. A, 43, 9, 5153, 1991.
